Décontamination du petit matériel par traitement thermique en étuve de séchage
Une démarche de complément de nettoyage et désinfection classiques par un traitement thermique a été mise en place pour améliorer la décontamination du matériel entrant dans les élevages de porcs et de volailles, en réponse aux exigences sanitaires et de biosécurité.
Face à la pression sanitaire et aux efforts de biosécurité demandés aux éleveurs, nous avons engagé une démarche pour améliorer la qualité de la décontamination du matériel qui entre dans les élevages de porcs et de volailles. Cette démarche permet une meilleure sécurisation de l’introduction de matériel en élevage et des audits effectués par Chêne Vert.
Le principe est de soumettre le matériel à un traitement thermique après avoir réalisé le nettoyage et la désinfection classiquement mis en place dans nos structures. Les résultats des prélèvements réalisés nous ont montré l’efficacité de la méthode avec une réduction du nombre de germes après passage à l’étuve.
1- Contexte et objectif
Dans notre clientèle, plusieurs types de matériels sont susceptibles d’être utilisés dans plusieurs élevages :
- Matériels dédiés aux audits et au suivi technique et sanitaire
Saisie de données (tablettes), mesures (mètre ruban, mètre laser, sonde ultrason ELD…)
- Matériels de prêt aux éleveurs ou de prestation
- Appareil de vaccination intradermique, dispositif de nettoyage des canalisations d’eau (APIRE)
Si la recommandation de base est que l’élevage mette à disposition des intervenants le maximum de matériel en propre, la fréquence d’usage ou le coût d’acquisition rendent inévitable l’utilisation du matériel technique de pointe extérieur à l’élevage. Dès lors les intervenants et l’éleveur doivent s’assurer que ces matériels soient désinfectés/indemnes d’agents pathogènes de manière à réduire au maximum le risque de contamination inter-élevages.
Le processus habituel consiste à nettoyer et désinfecter le matériel à la sortie de l’élevage et/ou au retour au bureau par traitement chimique (détergent, désinfectant), en surface ou par immersion selon le matériel.
Objectif du projet : Ajouter une sécurité supérieure, avec une double désinfection par ajout d’un procédé différent.
2- Méthode et résultats
2.1 - Synthèse des méthodes disponibles (H2O2, UV, etc…) avantages / inconvénients
Tableau 1 : Exemples d’autres méthodes de désinfection disponibles.
|
Méthodes disponibles |
Avantages |
Inconvénients |
|
H2O2 |
S’utilise sur une grande variété de surface et de matériel |
Risques pour l’utilisateur en cas de contact direct ou d’inhalation |
|
Ultraviolet |
Bonne efficacité en détruisant ou en inactivant les micro-organismes |
Les surfaces non exposées au rayonnement direct ne sont pas désinfectées |
|
Stérilisation |
Si chaleur sèche : 30 min à 180°C ou 2 h à 160°C |
Altération du matériel à des températures supérieures ou égales à 121°C |
|
Oxyde d’éthylène |
Utilisation pour du matériel thermosensible |
Nécessite une chambre étanche |
2.2 - Contraintes propres au matériel et choix de la méthode
Le matériel que nous rentrons en élevage est varié tant au niveau des matériaux (caoutchouc, plastique, métal, …) avec des différences de résistance aux contraintes du milieu, que du système de fonctionnement (sans énergie électrique, avec batterie non amovible, avec batterie amovible, sur secteur …). La méthode de décontamination utilisée doit prendre en compte tous ces éléments.
La méthode par traitement thermique représente la meilleure option aussi bien sur le côté pratique que du point de vue de la sécurité du personnel pour sécuriser davantage l’introduction du matériel dans les élevages.
Contrairement à l’équipement d’un sas de visite, la durée de décontamination est moins contraignante s’agissant d’une utilisation au bureau entre deux journées de travail. Le choix de l’étuve s’est basé sur les points suivants : efficacité de la décontamination, respect des matériels, facilité d’usage et de mise en place dans nos locaux.
Le volume intérieur maximum nécessaire a été évalué en amont afin de rentabiliser au mieux la mise en fonctionnement de l’appareil.
2.3 - Choix du couple température/durée de traitement
Nous avons pris en compte les données bibliographiques présentes dans le tableau 2 situé plus bas dans cet article, mais aussi les contraintes de résistances thermiques du matériel utilisé.
Dans ce tableau 2 sont indiqués différents pathogènes avec la température et la durée minimum d’exposition pour les rendre inactifs.
Les appareils contenants une batterie non amovibles ne peuvent pas être introduits dans l’étuve.
Le protocole est le suivant : introduire dans l’étuve du matériel nettoyé et désinfecté comme nous le faisions habituellement, puis passer ce matériel à l’étuve pendant 3h à 60°C.
Tableau 2 : Données bibliographiques de températures d’inactivation de diférents pathogènes.
|
Pathogène |
Source |
Température |
Durée |
|
Porcins |
|
|
|
|
SDRP |
(2) |
60°C |
40 min |
|
PPA |
(1) |
60°C |
30 min |
|
Grippe porcine H1N1 |
(3) |
56°C |
15 min |
|
Virus diarrhée épidémique porcine |
(8) |
60°C |
30 min |
|
Virus de la gastroentérite transmissible |
(5) |
60°C |
10 min |
|
Rotavirus |
(5) |
60°C |
1 min |
|
Streptococus suis |
(5) |
60°C |
3 min |
|
Actinobacillus pleuropneumoniae |
(5) |
60°C |
1 min |
|
Escherichia coli |
(5) |
60°C |
1 h |
|
Volailles |
|
|
|
|
Salmonella typhimurium |
(9) |
60°C |
1 h |
|
Influenza aviaire H5N1 |
(6) |
56°C |
30 min |
|
Influenza aviaire H7N9 |
(10) |
56°C 65°C |
30 min 10 min |
2.4 - Validation de la méthode par étuvage
Avant d’utiliser l’étuve en routine, nous avons validé ce protocole par des analyses en laboratoire. Nous avons utilisé la technique de chiffonnettes avec neutralisant et recherché la flore aérobie mésophile (indicateur de la charge bactérienne…). Quatre essais ont été réalisés à des dates différents (en novembre et décembre 2024) et sur quatre types de matériel. Les résultats sont présentés sur la figure 1.
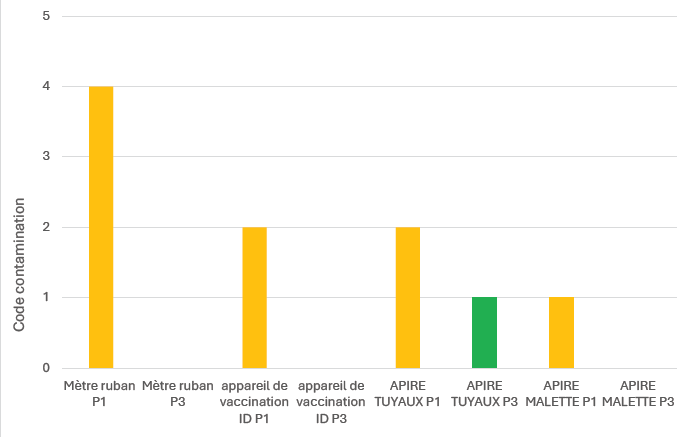
Figure 1 : Résultats du laboratoire après contrôle réalisé à l’aide de chiffonnettes avec neutralisant.
Légende :
Prélèvement P1=avant nettoyage/désinfection et avant passage à l’étuve ; P3=après nettoyage désinfection et passage à l’étuve.
Code contamination : 0 = 0 germe ; 1 = 1 à 9 germes ; 2 = 10 à 49 germes ; 3 = 50 à 300 germes ; 4 = supérieur à 300 germes.
> Nous pouvons lire sur le graphique 1 que le niveau de flore aérobie mésophile est diminué après nettoyage désinfection et passage à l’étuve. L’utilisation de l’étuve nous permet de sécuriser l’étape de désinfection pour du matériel un peu délicat à désinfecter. L’utilisation de l’étuve en routine a débuté début janvier 2025.
2.5 - Contrôle qualité
Afin de bien maitriser la non-contamination de l’étuve elle-même et de maintenir un contrôle de l’efficacité de notre protocole, nous réalisons un contrôle mensuel sur trois objets à l’aide de chiffonnettes avec neutralisant (recherche flore aérobie mésophile). L’intérieur de l’étuve est aussi contrôlé, après fonctionnement, avec une chiffonnette pour recherche de Salmonelles et une boite de contact pour recherche d’Entérocoques.
Les résultats du mois de janvier et février 2025 sont présentés dans les tableaux 3 et 4.
Tableau 3 : Résultats du laboratoire pour recherche de flore aérobie mésophile.
|
Date |
Objets |
Avant étuve |
Après étuve |
|
Janvier 2025 |
Niveau à bulle |
0 |
0 |
|
Malette multimètre |
0 |
0 |
|
|
Câbles multimètre |
1 |
0 |
|
|
Février 2025 |
Malette multimètre |
0 |
0 |
|
Câbles multimètre |
0 |
0 |
|
|
Tuyaux APIRE |
2 |
1 |
Tableau 4 : Résultats du laboratoire pour recherche de Salmonelles et Entérocoques.
|
Date |
Recherches |
Résultat |
|
Janvier 2025 |
Salmonelles |
Négatif |
|
Entérocoques |
0 |
|
|
Février 2025 |
Salmonelles |
X (défaut de prélèvement) |
|
Entérocoques |
0 |
>Tableau 3, les niveaux de contamination sont déjà bas avant passage à l’étuve, dans le cas des Câbles du multimètre et des tuyaux de l’APIRE, le passage à l’étuve permet de réduire de 1 point la contamination. Les résultats présentés dans le tableau 4 permettent de nous conforter dans notre hypothèse de non-contamination de l’étuve après plusieurs utilisations pour du matériel qui revient aussi bien d’élevages de porcins que d’élevages de volailles.
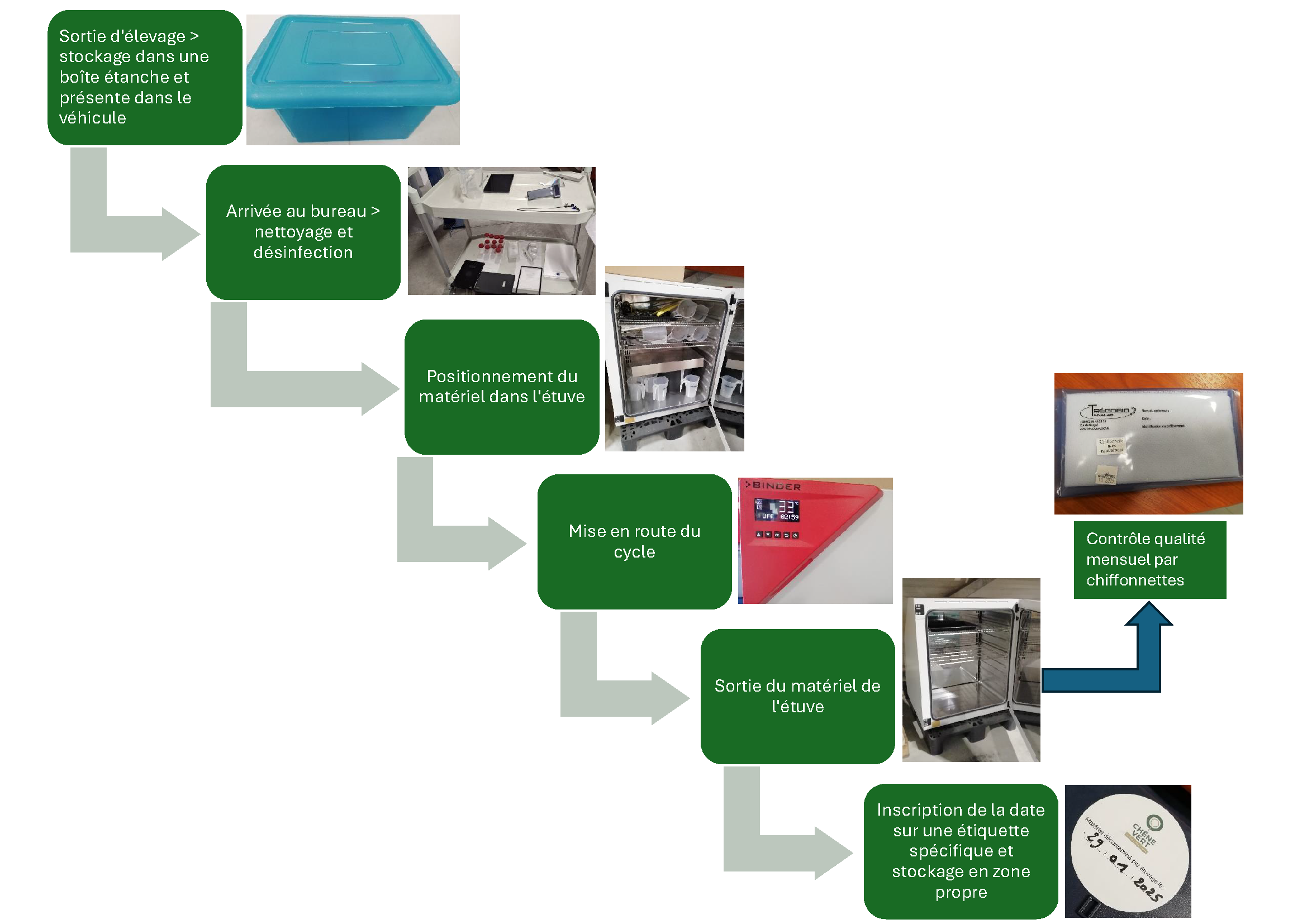
3. Le processus en pratique
Pour en savoir plus, contactez Amel Taktak, ingénieure en filière porc chez Chêne Vert.
Sources bibliographiques :
- Avis de l’Anses Saisine n°2018-SA-0237 Saisines liées n°2018-SA-0210, 2018-SA-0218 ; EFSA Panel on Animal Health Welfare. 2010. "Scientific opinion on African swine fever." EFSA Journal 8 (3):1556.
- Bureau d’Inspection Vétérinaire, Alimentaire et Phytosanitaire (BIVAP) TERRITOIRE DES ILES WALLIS ET FUTUNA ; Service d’État de l’Agriculture, de la Forêt et de la Pêche (ANNEXE XI : PROCEDURES D’INACTIVATION DES AGENTS PATHOGENES AGRÉÉES PAR LE TERRITOIRE DES ILES WALLIS ET FUTUNA).
- Centre de Recerca en Sanitat Animal (CReSA) ; Official Master's Degree in Zoonoses and One Health ; Gabriela Asenjo Andrews ; 2017-2018.
- Fiche Technique Santé-Sécurité : Agents Pathogènes – Mycoplasma spp. ; Gouvernement du Canada (2011).
- Jill van Kessel et al., 2020. Time and temperature requirements for heat inactivation of pathogens to be applied to swine transport trailers.
- Muhammad et al., 2009. Avian influenza virus (H5N1) ; effects of physico-chemical factors on its survival. Virol J. 6 : Article number 38.
- National Institutes of Health (NIH) 2008.
- Pospischil A, Stuedli A, Kiupel M. Update on porcine epidemic diarrhea. J Swine Health Prod. 2002 ; 10 : 81-85.
- Sagor Biswas et al., 2019. Thermal Inactivation of Excherichia coli and Salmonella Typhimurium in Poultry carcass and litter at thermophilic temperatures.
- Shumei et al., 2013. Inactivation of the novel avian influenza A (H7N9) virus under physical conditions or chemical agents treatment. Virol J. 2013 Sep 15;10:289.

